4月9日,奥地利科学技术研究所冯小琦团队在Cell发表了题为Extensive N4 Cytosine Methylation is Essential for Marchantia Sperm Function的研究论文,首次证明了4mC在真核生物中的存在,并详实地阐明,在精子成熟阶段,基因组上发生了广泛的4mC修饰,这对于精子发育与功能至关重要。华南农业大学生命科学学院刘亚林教授作为共同第一作者。
作为表观遗传学的重要修饰,DNA甲基化广泛存在于原核与真核生物中,并发挥关键调控作用。在原核生物中,DNA上胞嘧啶(Cytosine, C)的第四位氮元素可被甲基化修饰形成N4-甲基胞嘧啶(4mC)、第五位碳元素可被甲基化修饰形成C5-甲基胞嘧啶(5mC),腺嘌呤的第六位氮元素可被甲基化修饰形成N6-甲基腺嘌呤(6mA),虽然基因组上甲基化程度不高(大肠杆菌中,约0.5%-0.8%的胞嘧啶,1.5%-2%的腺嘌呤会被甲基化修饰),但DNA甲基化依然发挥着重要的作用,参与调控基因表达和防御反应。然而,在真核生物中,迄今仅发现5mC在基因组上广泛分布,6mA在单细胞生物中有零星分布,而4mC是否存在则仍有很大争议。
在真核生物中,DNA甲基转移酶Dnmt1和Dnmt3介导5mC的甲基化过程,该机制在各物种中高度保守。不同物种的5mC分布有所差异:在脊椎动物中,5mC主要发生在全基因组范围内的CG位点,约80%的CG在人体组织中被甲基化为5mCG;而在开花植物中,5mC则主要发生在转座子区域(Transposon Elements, TE),并存在在CG、CHG和CHH(H代表A、C或T)位点。在动植物的发育过程中,5mC水平在很大程度上保持稳定,一旦紊乱常导致严重发育异常和疾病。然而,在哺乳动物和开花植物的雄性生殖细胞(精子)发育过程中,5mC会经历重编程,这对精子成熟至关重要。

研究发现,4mC在陆地植物地钱 (Marchantia polymorpha) 精子发育过程中由一个新发现的甲基转移酶 (Marchantia polymorpha DNA N4 CYTOSINE METHYLTRANSFERASE1a, MpDN4MT1a) 修饰生成。该研究还发现精子发育经历了两波DNA甲基化重编程:第一波是由MpCMTa和MpDNMT3b调控的5mC重编程,表现为non-CG (CHG和CHH) 位点的全基因组扩张及转座子区域CG位点甲基化的增强;第二波是由MpDN4MT1a调控的4mCG重编程,特异发生于基因区域(genic region)并在精子成熟后期发生(图1)。
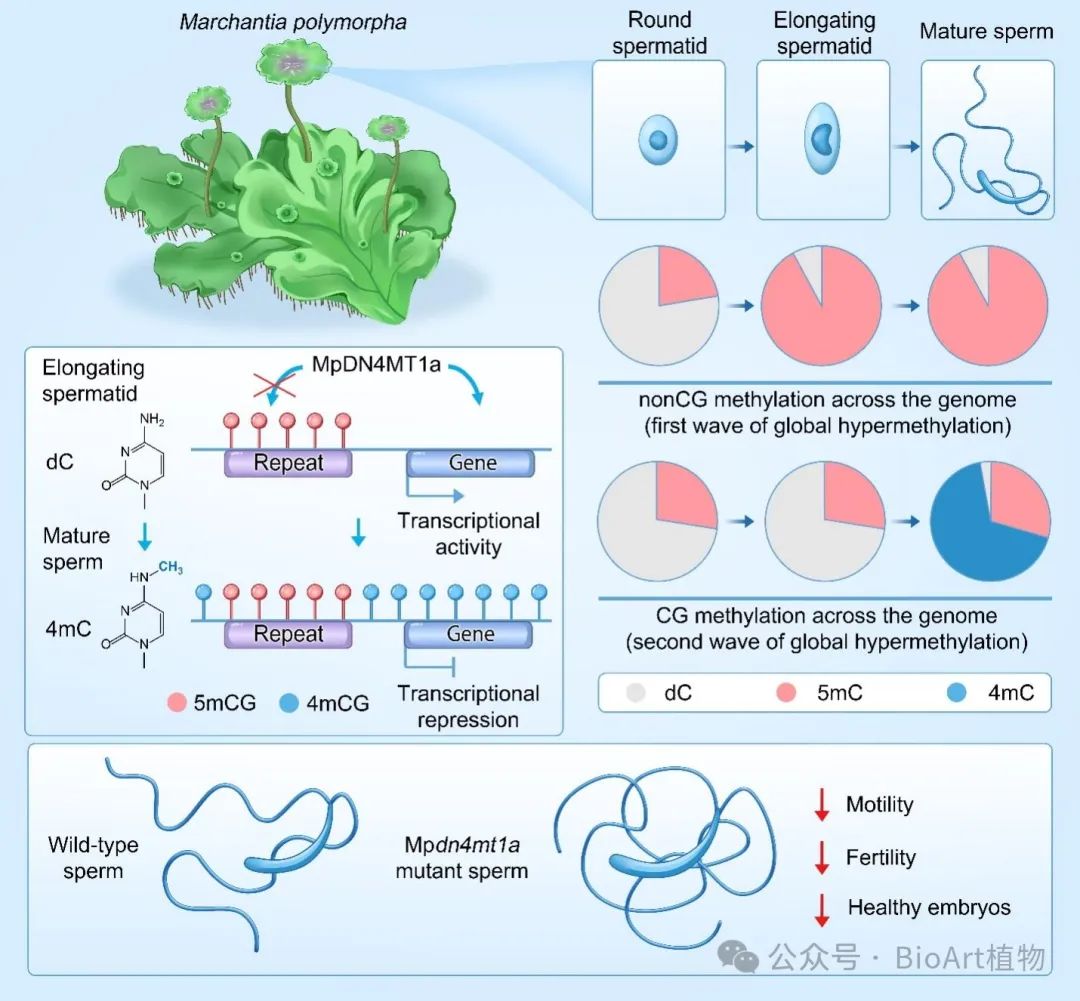
图1地钱精子发育过程中甲基化重编程及4mC作为功能性DNA修饰的作用机制
进一步研究发现,全基因组范围内,精子基因组的DNA甲基化水平从营养组织(Thallus)的17%显著上升至成熟精子(Mature sperm)的96%。为了研究这一显著的DNA甲基化变化过程,作者分离了不同发育阶段的精子前体细胞群,结合转录组、甲基化组和发育时期同步分析精子发育过程中的DNA甲基化水平的变化。结果显示,在精子发育过程中,除转座子区外的基因组范围内,有两波(two waves)不同的DNA甲基化修饰的发生,第一波发生在non-CG上,而后第二波发生在CG上。这种全基因组的DNA甲基化修饰与精子的成熟过程高度相关,并且这种现象并不存在于受精后的胚胎 (Embryo,图2)。
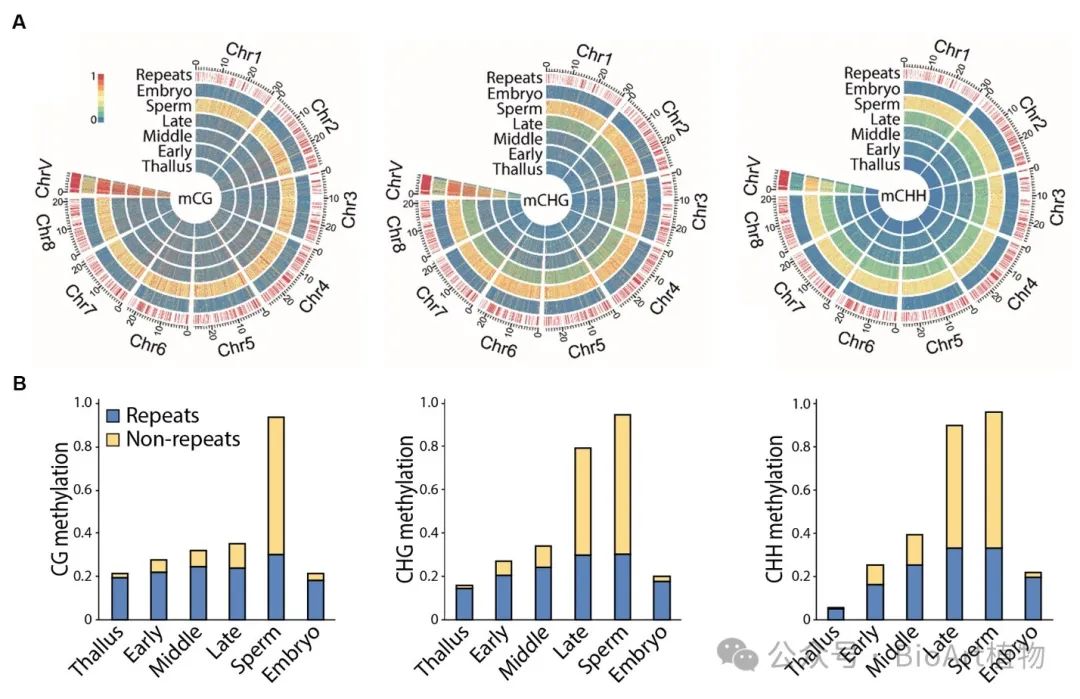
图2 精子发育过程中两次广泛的DNA甲基化重编程。A,热图显示了野生型Tak1不同组织中染色体上10 kb窗口的甲基化情况;B,条形图显示了不同组织中具有明显甲基化的100 bp基因组窗口的百分比。
结合转录组和遗传学分析,作者发现了两个5mC甲基转移酶(MpDNMT3b和MpCMTa)在精子发育过程中表达量升高,并进而确认了他们参与调控发生在non-CG的5mC甲基化的重编程(first wave,第一波),但不负责发生在CG上的重编程(second wave,第二波)(图3)。
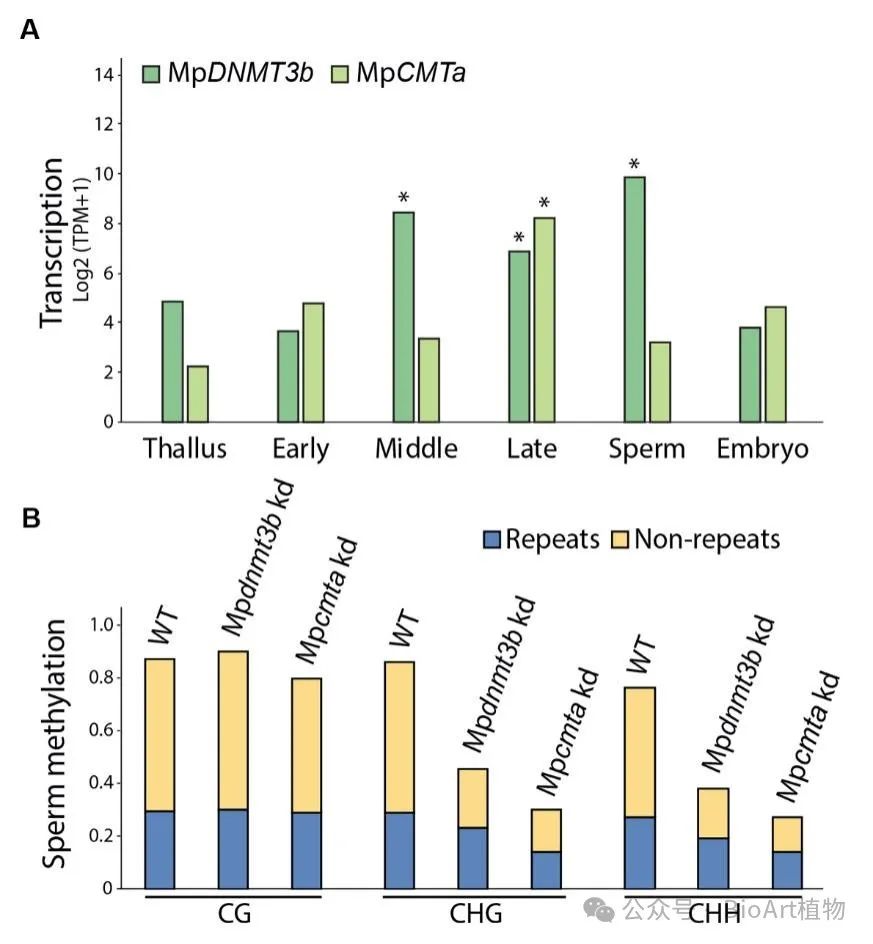
图3 精子发育过程中non-CG甲基化重编程由5mC甲基转移酶MpDNMT3b和MpCMTa介导诱导。A,MpDNMT3b和MpCMTa在不同组织中的转录水平。TPM表示每百万转录本数量。B,条形图展示了在野生型(WT)、Mpdnmt3b敲低(kd)和Mpcmta敲低(kd)精子中,CG、CHG或CHH甲基化水平大于0.3的100 bp基因组窗口的百分比。
虽然没有任何5mC甲基转移酶的表达和精子的第二波重编程相关,但令人兴奋的是,作者发现了两个全新的甲基转移酶MpDN4MT1s (M. polymorpha DNA 4mC Methyltransferase1a and 1b, MpDN4MT1a and MpDN4MT1b)。MpDN4MTs不与5mC甲基转移酶同源,但和原核生物的4mC甲基转移酶高度同源。他们在精子发育后期特异表达,暗示他们可能负责第二波发生在CG上的DNA甲基化重编程。作者通过点杂交(Dot blot),液相质谱(LC-MS),和遗传学方法,检测并证实了成熟精子中存在4mC修饰,并且是由MpDN4MT1a介导产生的(图4):

图4 地钱精子中广泛存在4mC,且依赖于MpDN4MT1a。A,MpDN4MT1a和MpDN4MT1b在不同组织中的转录水平;B,系统进化树展示了与两种MpDN4MT1s同源的原核生物5mC和4mC甲基转移酶;C,用4mC抗体进行DNA点杂交免疫检测;D,LC-MS检测甲基化脱氧胞苷标准品和从不同样本中提取的DNA酶解后甲基化脱氧胞苷的峰图。
因为经典的检测DNA甲基化程度的重亚硫酸盐测序 (Bisulfite Sequencing, BS-seq) 不能区别4mC和5mC,所以作者进一步通过单分子实时测序(SMRT-seq)、TET酶辅助的重亚硫酸盐测序技术 (4mC-TAB-seq)、APOBEC介导的脱氨基测序技术(4mC-AMD-seq)和遗传学分析,证实了第二波发生在CG上的甲基化实则是4mC甲基化,由MpDN4MT1a介导,覆盖精子基因组50%以上的CG位点,为真核生物中4mC的存在提供了强有力证据(图5)。
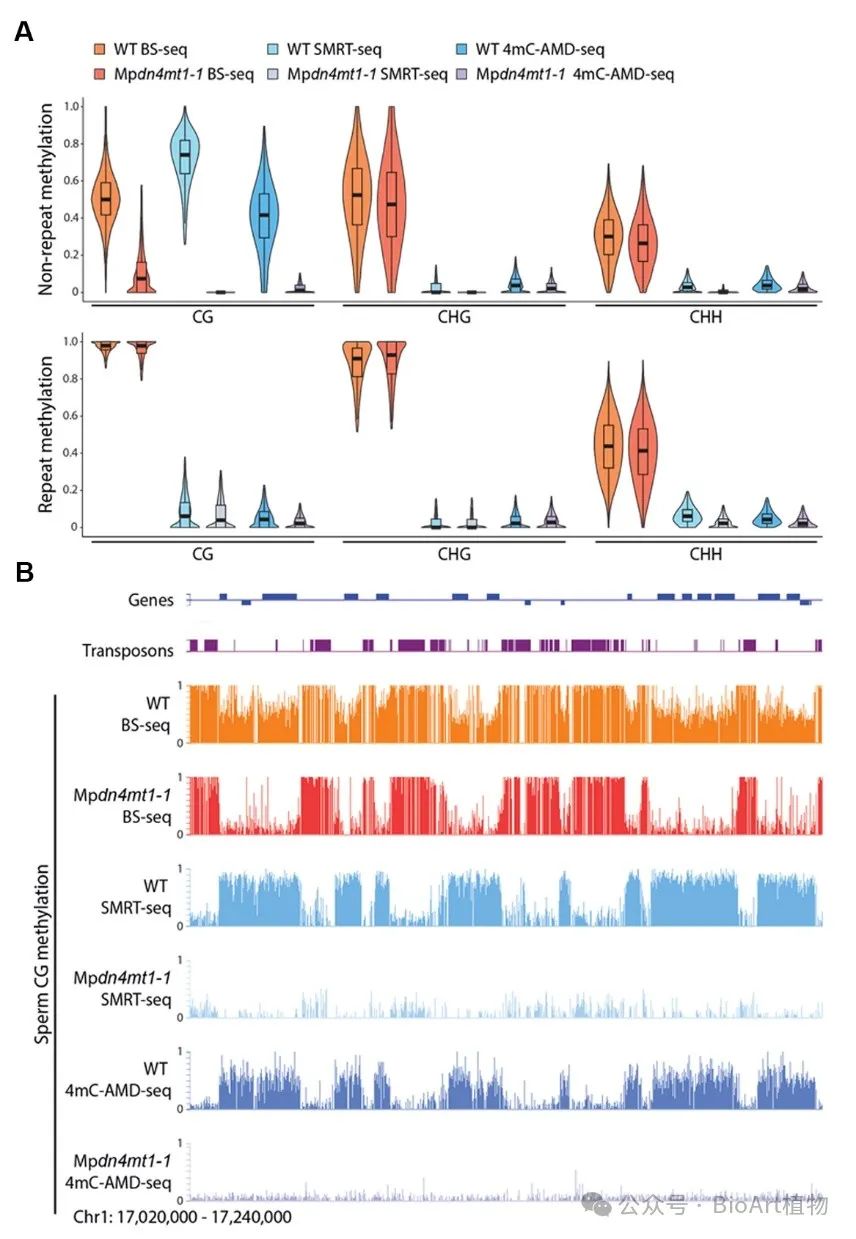
图5 4mC发生于CG位置并富集于基因区域。A,小提琴图展示在WT和Mpdn4mt1-1精子中,通过BS-seq,SMRT-seq和4mC-AMD-seq检测到的100-bp基因组窗口的重复序列(Repeats)和非重复序列(Non-repeats)的甲基化情况;B,展示WT和Mpdn4mt1-1精子中部分基因和转座子序列的CG甲基化的情况。
此外,作者通过CRISPR-Cas9敲除MpDN4MT1a基因,发现突变体精子的染色体可及性增强以及转录组紊乱,并表现出精子游动异常(速度减慢、不定向),育性有缺陷,影响受精后发育。这些结果表明4mC在精子发育和功能中具有关键作用(图6)。
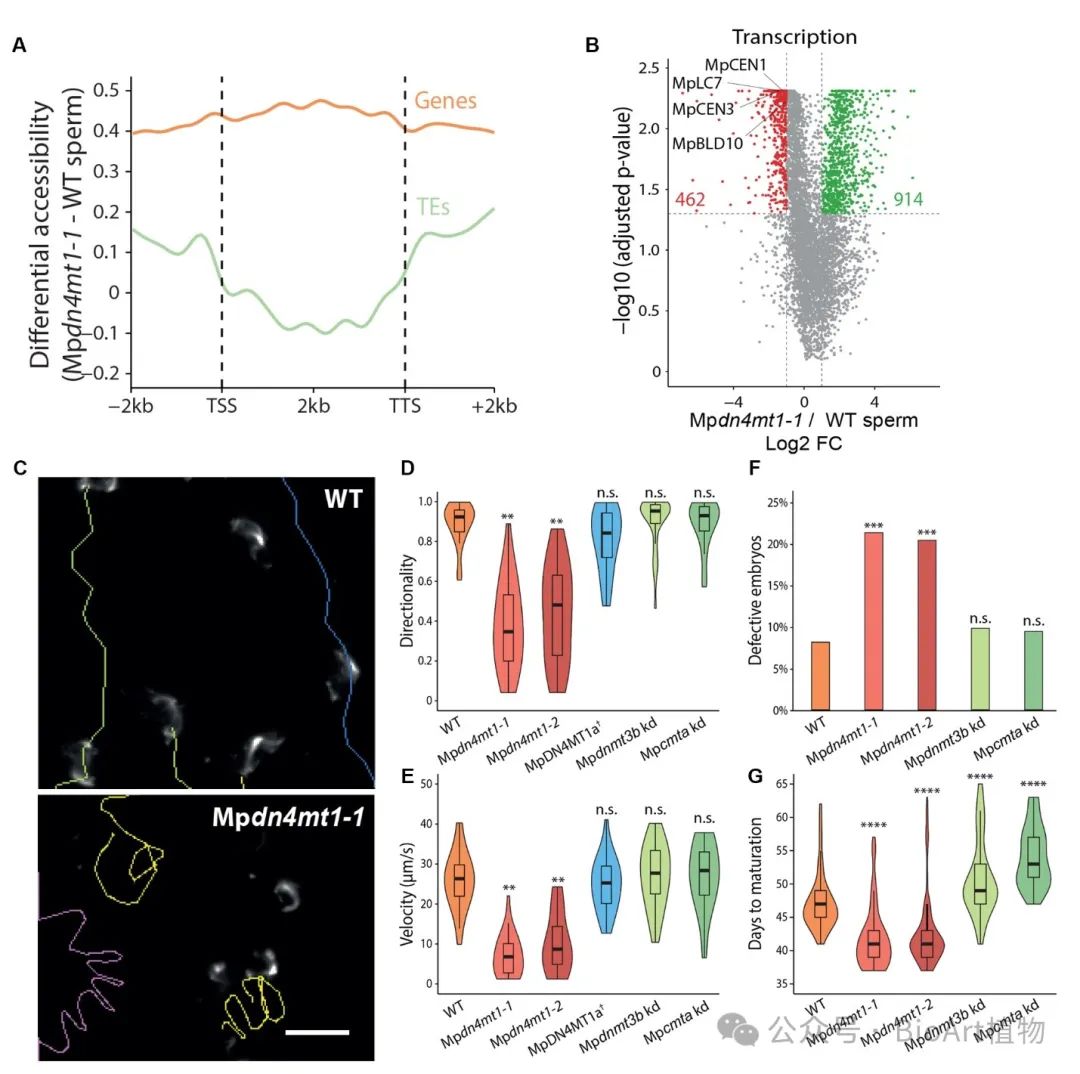
图6 4mC对精子功能和受精后发育至关重要。A,Mpdn4mt1-1突变与WT精子中基因和转座元件(TEs)差异可及性(通过ATAC-seq测量)的概况;B,火山图展示了Mpdn4mt1-1与WT精子相比,上调(绿色)或下调(红色)的转录本。C,Mpdn4mt1-1与WT精子游动路径;D、E,不同材料中精子活动的方向性和速度的统计结果;F,不同材料中异常胚胎的百分比;G,不同材料中胚胎成熟所需的天数。
作者同时还揭示了地钱精子发育中的两波DNA甲基化重编程过程,该过程最终形成了特有的全基因组甲基化修饰模式(覆盖率97%)(图7)。
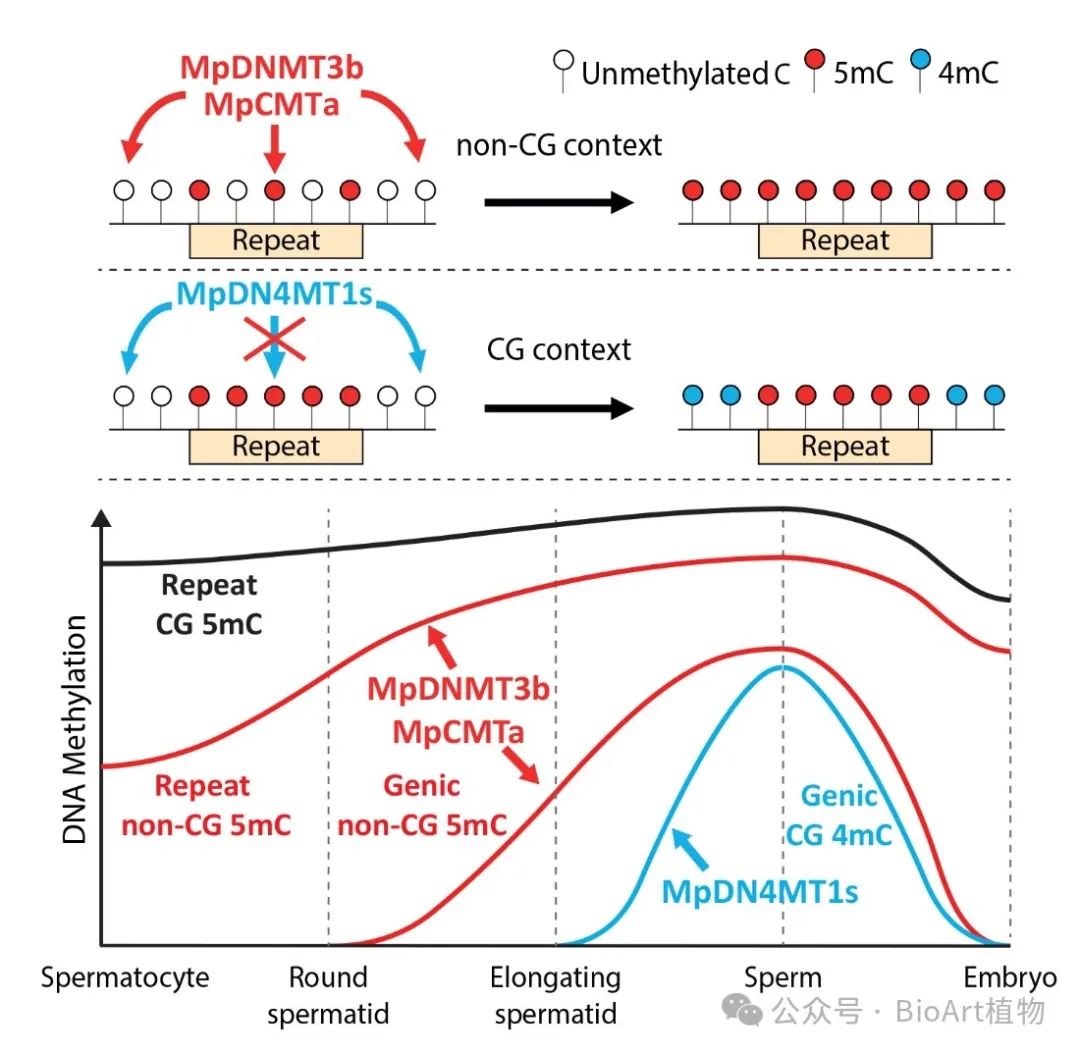
图7. 地钱精子发育过程中甲基化重编程的时间模式与机制
综上,该研究首次证实了4mC在真核生物中的存在,揭示了在地钱精子成熟过程中基因组范围内编码区的大规模4mC修饰,保障了精子的正常发育和正常功能,对精子命运的重要决定性,发现并鉴定了负责4mC修饰的真核4mC甲基转移酶。此研究拓展了真核生物中表观遗传学的认知,发现了参与生殖发育过程至关重要的表观遗传学新修饰,开创了4mC在真核生物中功能的研究新方向,拓展了表观遗传学领域的边界。
该论文的通讯作者为现任奥地利科学技术研究所(ISTA),前任英国John Innes Centre (JIC) 的冯小琦教授。James Walker (JIC, 现任职于The Salk Institute)、张静懿(JIC,现任职于华南农业大学农学院)、刘亚林(JIC,现任职于华南农业大学生命科学学院)和许淑娟(ISTA)为本文共同第一作者。于义溟 (ISTA) 、Martin Vickers (JIC) 、欧阳维枝(ISTA) 、Judit Tálas (JIC) 、Liam Dolan (Gregor Mendel Institute of Molecular Plant Biology)、Keiji Nakajima (Nara Institute of Science and Technology) 参与了研究。
(图文转载至微信公众号:BioArt植物)